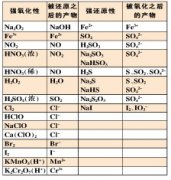
1、氧化还原反应的基本概念:
氧化反应和还原反应:氧化反应表现为被氧化的元素化合价升高,其实质是该元素的原子失去电子(或共用电子对偏离)的过程;还原反应表现为被还原的元素化合价降低,其实质是该元素的原子获得电子(或共用电子对偏向)的过程。氧化还原反应的概念可以用下面的式子表示:
2、氧化产物和还原产物:被氧化生成的物质是氧化产物,被还原生成的物质是还原产物。
常见的氧化剂有O2、Cl2、浓硫酸、HNO3、KMnO4、FeCl3等;常见的还原剂有活泼的金属单质、H2、C、CO等。
3、氧化还原中电子转移的表示方法:使用双线桥或单线桥表示出电子转移的方向和数目,二者的区别在于,使用双线桥需要标出电子的得失,而单线桥不需要。
4、氧化还原反应方程式的配平是一个难点,在掌握化合价升降相等的基础上再掌握一些配平时需要的技巧,就可以解决多数的问题。
常见考法
经常以选择题、填空题的形式考查氧化还原反应的基本概念,得失电子的表示方法。以探究题的形式考查氧化还原反应的配平以及相关计算。
误区提醒
比较物质的氧化性、还原性强弱的方法
根据氧化还原反应的化学方程式进行判断:在一个氧化还原反应中,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。②根据金属活动性顺序判断:金属活动性越强,其还原性越强,即:还原性:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag
金属的还原性越强,其失去电子后形成的金属离子的氧化性越弱,即:
氧化性:K+2++2+3+2+2+2+2++)2+2++
Fe3+可以和铜反应:2Fe3+ + Cu = 2Fe2+ + Cu2+,因此氧化性:Fe3+> Cu2+。
【典型例题】
在热的稀硫酸溶液中溶解了11.4g硫酸亚铁,当加入50mL 0.5mol·L-1KNO3溶液后,其中Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
FeSO4 + KNO3 + H2SO4 → K2SO4 +Fe2(SO4)3 + NxOy + H2O
(1)推算出x=___________,y=___________
(2)配平该化学方程式
(3)反应中氧化剂为____________________
(4)用短线和箭头标出电子转移的方向和数目
解析:
(1)11.4g硫酸亚铁的物质的量为n(FeSO4)=0.075mol,n(KNO3)=0.025mol。当其中的Fe2+全部被氧化生成Fe3+时,失去0.075mol电子,则KNO3被还原时得到0.075电子,平均每个NO3-得到3个电子,氮元素的化合价由+5降低为+2,即NxOy应为NO,x=1,y=1。
(2)根据题意,FeSO4和KNO3的化学计量数之比为3:1,其他反应物和生成物的系数可根据观察法进行配平。
(3)氧化剂中的元素在反应中化合价降低,该反应的氧化剂应为KNO3。
答案:
(1)x=1,y=1;
(2)6FeSO4 + 2KNO3 + 4H2SO4 == K2SO4 + 3Fe2(SO4)3 + 2NO↑ + 4H2O
(3)KNO3
(4)
随机阅读
- [高考化学备考] 怎样掌握高中化学学习方法
- [高考化学备考] 化学解决计算题失分的步骤
- [高考化学备考] 高考化学知识点:常见的氧
- [高考化学备考] 高中化学学习中总结的四个
- [高考化学备考] 高三化学知识点 化学反应
- [高考化学备考] 高考化学复习指导:轻重分
- [高考化学备考] 高考化学知识点:带颜色的
- [高考化学备考] 怎样做化学元素推断题
- [高考化学备考] 理综化学大题高分技巧
- [高考化学备考] 高中化学离子方程式判断
- [高考化学备考] 高中化学方程式总结
- [高考化学备考] 高考化学学习防范:化学知
- [高考化学备考] 高中化学易错知识点
- [高考化学备考] 高考化学复习方法: 改变
- [高考化学备考] 高三化学知识点 电解质
- [高考化学备考] 化学教学中渗透绿色化学教