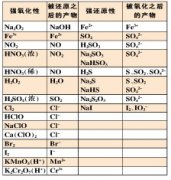
盐的离子跟水电离出来的氢离子或氢氧根离子生成弱电解质的反应,称为盐类的水解。
其一般规律是:谁弱谁水解,谁强显谁性;两强不水解,两弱更水解,越弱越水解。
哪么在哪些情况下考虑盐的水解呢?
1.分析判断盐溶液酸碱性时要考虑水解。
2.确定盐溶液中的离子种类和浓度时要考虑盐的水解。
如Na2S溶液中含有哪些离子,按浓度由大到小的顺序排列:
C(Na+ )>C(S2-)>C(OH-)>C(HS-)>C(H+)
或:C(Na+) +C(H+)=2C(S2-)+C(HS-)+C(OH-)
3.配制某些盐溶液时要考虑盐的水解
如配制FeCl3,SnCl4 ,Na2SiO3等盐溶液时应分别将其溶解在相应的酸或碱溶液中。
4.制备某些盐时要考虑水解Al2S3 ,MgS,Mg3N2 等物质极易与水作用,它们在溶液中不能稳定存在,所以制 取这些物质时,不能用复分解反应的方法在溶液中制取,而只能用干法制备。
5.某些活泼金属与强酸弱碱溶液反应,要考虑水解
如Mg,Al,Zn等活泼金属与NH4Cl,CuSO4 ,AlCl3 等溶液反应.3Mg+2AlCl3 +6H2O=3MgCl2+2Al(OH)3↓+3H2↑
6.判断中和滴定终点时溶液酸碱性,选择指示剂以及当pH=7时酸或碱过量的判断等问题时,应考虑到盐的水解.如CH3COOH与NaOH刚好反应时pH>7,若二者反应后溶液pH=7,则CH3COOH过量。指示剂选择的总原则是,所选择指示剂的变色范围应该与滴定后所得盐溶液的pH值范围相一致。即强酸与弱碱互滴时应选择甲基橙;弱酸与强碱互滴时应选择酚酞。
7.制备氢氧化铁胶体时要考虑水解.FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
8.分析盐与盐反应时要考虑水解.两种盐溶液反应时应分三个步骤分析考虑:
(1)能否发生氧化还原反应; (2)能否发生双水解互促反应;
(3)以上两反应均不发生,则考虑能否发生复分解反应.
9.加热蒸发和浓缩盐溶液时,对最后残留物的判断应考虑盐类的水解
(1)加热浓缩不水解的盐溶液时一般得原物质.
(2)加热浓缩Na2CO3型的盐溶液一般得原物质.
(3)加热浓缩FeCl3 型的盐溶液.最后得到FeCl3和Fe(OH)3 的混合物,灼烧得Fe2O3 。
(4)加热蒸干(NH4)2CO3或NH4HCO3 型的盐溶液时,得不到固体.
(5)加热蒸干Ca(HCO3)2型的盐溶液时,最后得相应的正盐.
(6)加热Mg(HCO3)2、MgCO3 溶液最后得到Mg(OH)2 固体.
10.其它方面
(1)净水剂的选择:如Al3+ ,FeCl3等均可作净水剂,应从水解的角度解释。
(2)化肥的使用时应考虑水解。如草木灰不能与铵态氮肥混合使用。
(3)小苏打片可治疗胃酸过多。
(4)纯碱液可洗涤油污。
(5)磨口试剂瓶不能盛放Na2SiO3,Na2CO3等试剂.
凡此种种,不一而举。学习中要具体情况具体分析,灵活应用之。
随机阅读
- [高考化学备考] 怎样掌握高中化学学习方法
- [高考化学备考] 化学解决计算题失分的步骤
- [高考化学备考] 高考化学知识点:常见的氧
- [高考化学备考] 高中化学学习中总结的四个
- [高考化学备考] 高三化学知识点 化学反应
- [高考化学备考] 高考化学复习指导:轻重分
- [高考化学备考] 高考化学知识点:带颜色的
- [高考化学备考] 怎样做化学元素推断题
- [高考化学备考] 理综化学大题高分技巧
- [高考化学备考] 高中化学离子方程式判断
- [高考化学备考] 高中化学方程式总结
- [高考化学备考] 高考化学学习防范:化学知
- [高考化学备考] 高中化学易错知识点
- [高考化学备考] 高考化学复习方法: 改变
- [高考化学备考] 高三化学知识点 电解质
- [高考化学备考] 化学教学中渗透绿色化学教